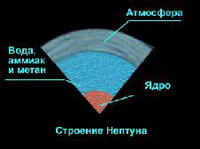
| –ù–Β–Κ–Ψ―²–Ψ―Ä―΄–Β ―¹–≤–Β–¥–Β–Ϋ–Η―è –Η–Ζ –Φ–Ψ–Μ–Β–Κ―É–Μ―è―Ä–Ϋ–Ψ–Ι ―³–Η–Ζ–Η–Κ–Η |
| –ù–Α―É–Κ–Α - –ê―¹―²―Ä–Ψ―³–Η–Ζ–Η–Κ–Α |
|
–‰–¥–Β–Α–Μ―¨–Ϋ―΄–Ι –≥–Α–Ζ. –ë–Ψ–Μ―¨―à–Η–Ϋ―¹―²–≤–Ψ –Α―¹―²―Ä–Ψ–Ϋ–Ψ–Φ–Η―΅–Β―¹–Κ–Η―Ö –Ψ–±―ä–Β–Κ―²–Ψ–≤ ―¹–Ψ―¹―²–Ψ–Η―² –Η–Ζ –≥–Α–Ζ–Α, –Κ–Ψ―²–Ψ―Ä―΄–Ι –Φ–Ψ–Ε–Ϋ–Ψ ―Ä–Α―¹―¹–Φ–Α―²―Ä–Η–≤–Α―²―¨ –Κ–Α–Κ –Η–¥–Β–Α–Μ―¨–Ϋ―΄–Ι, ―²–Α–Κ ―΅―²–Ψ ―¹–Ω―Ä–Α–≤–Β–¥–Μ–Η–≤–Ψ –Ψ―¹–Ϋ–Ψ–≤–Ϋ–Ψ–Β ―É―Ä–Α–≤–Ϋ–Β–Ϋ–Η–Β ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η―è –£ ―ç―²–Ψ–Ι ―³–Ψ―Ä–Φ―É–Μ–Β ―Ä - –≤–Ϋ―É―²―Ä–Β–Ϋ–Ϋ–Β–Β –¥–Α–≤–Μ–Β–Ϋ–Η–Β –≥–Α–Ζ–Α, r¬†¬†¬† - –Β–≥–Ψ –Ω–Μ–Ψ―²–Ϋ–Ψ―¹―²―¨, m¬†¬† - –Φ–Ψ–Μ–Β–Κ―É–Μ―è―Ä–Ϋ―΄–Ι –≤–Β―¹ –≥–Α–Ζ–Α, –Δ - –Β–≥–Ψ –Α–±―¹–Ψ–Μ―é―²–Ϋ–Α―è ―²–Β–Φ–Ω–Β―Ä–Α―²―É―Ä–Α, R = 8,32 times;107 ―ç―Ä–≥/–≥―Ä–Α–¥ times; –Φ–Ψ–Μ―¨ - ―É–Ϋ–Η–≤–Β―Ä―¹–Α–Μ―¨–Ϋ–Α―è –≥–Α–Ζ–Ψ–≤–Α―è –Ω–Ψ―¹―²–Ψ―è–Ϋ–Ϋ–Α―è. –ö–Α–Κ –Η–Ζ–≤–Β―¹―²–Ϋ–Ψ, –Ψ―²–¥–Β–Μ―¨–Ϋ―΄–Β –Φ–Ψ–Μ–Β–Κ―É–Μ―΄, –Η–Ζ –Κ–Ψ―²–Ψ―Ä―΄―Ö ―¹–Ψ―¹―²–Ψ–Η―² –≤–Β―â–Β―¹―²–≤–Ψ, –Ϋ–Α―Ö–Ψ–¥―è―²―¹―è –≤ –±–Β―¹–Ω–Ψ―Ä―è–¥–Ψ―΅–Ϋ–Ψ–Φ ―²–Β–Ω–Μ–Ψ–≤–Ψ–Φ –¥–≤–Η–Ε–Β–Ϋ–Η–Η. –ï―¹–Μ–Η –Φ–Ψ–Μ–Β–Κ―É–Μ–Α, –Η–Φ–Β―é―â–Α―è –Φ–Α―¹―¹―É ―², –¥–≤–Η–Ε–Β―²―¹―è ―¹–Ψ ―¹–Κ–Ψ―Ä–Ψ―¹―²―¨―é v ,¬† ―²–Ψ –Β–Β –Κ–Η–Ϋ–Β―²–Η―΅–Β―¹–Κ–Α―è ―ç–Ϋ–Β―Ä–≥–Η―è ―Ä–Α–≤–Ϋ–Α –Δ–Β–Ω–Μ–Ψ–≤–Α―è ―ç–Ϋ–Β―Ä–≥–Η―è ―²–Β–Μ–Α ―¹–Κ–Μ–Α–¥―΄–≤–Α–Β―²―¹―è –Η–Ζ –Κ–Η–Ϋ–Β―²–Η―΅–Β―¹–Κ–Ψ–Ι ―ç–Ϋ–Β―Ä–≥–Η–Η –≤―¹–Β―Ö –Β–≥–Ψ –Φ–Ψ–Μ–Β–Κ―É–Μ. –‰–Ζ-–Ζ–Α ―΅–Α―¹―²―΄―Ö ―¹―²–Ψ–Μ–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η–Ι, ―¹–Κ–Ψ―Ä–Ψ―¹―²–Η, –Α –≤–Φ–Β―¹―²–Β ―¹ –Ϋ–Η–Φ–Η –Η –Κ–Η–Ϋ–Β―²–Η―΅–Β―¹–Κ–Α―è ―ç–Ϋ–Β―Ä–≥–Η―è ―²–Β–Ω–Μ–Ψ–≤―΄―Ö –¥–≤–Η–Ε–Β–Ϋ–Η–Ι –Ψ―²–¥–Β–Μ―¨–Ϋ―΄―Ö –Φ–Ψ–Μ–Β–Κ―É–Μ –Ω–Ψ―¹―²–Ψ―è–Ϋ–Ϋ–Ψ –Φ–Β–Ϋ―è―é―²―¹―è. –û–¥–Ϋ–Α–Κ–Ψ –Φ–Ψ–Ε–Ϋ–Ψ –≥–Ψ–≤–Ψ―Ä–Η―²―¨ –Ψ –≤–Β–Μ–Η―΅–Η–Ϋ–Β ―²–Β–Ω–Μ–Ψ–≤–Ψ–Ι ―ç–Ϋ–Β―Ä–≥–Η–Η, –Κ–Ψ―²–Ψ―Ä–Α―è –≤ –Κ–Α–Ε–¥―΄–Ι –¥–Α–Ϋ–Ϋ―΄–Ι –Φ–Ψ–Φ–Β–Ϋ―² –≤ ―¹―Ä–Β–¥–Ϋ–Β–Φ –Ω―Ä–Η―Ö–Ψ–¥–Η―²―¹―è –Ϋ–Α –Ψ–¥–Ϋ―É ―΅–Α―¹―²–Η―Ü―É. –£–Β–Μ–Η―΅–Η–Ϋ–Α, ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Η–Ζ―É―é―â–Α―è ―²–Β–Ω–Μ–Ψ–≤–Ψ–Β ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η–Β ―²–Β–Μ–Α –Η –Ω―Ä–Ψ–Ω–Ψ―Ä―Ü–Η–Ψ–Ϋ–Α–Μ―¨–Ϋ–Α―è ―¹―Ä–Β–¥–Ϋ–Β–Ι –Κ–Η–Ϋ–Β―²–Η―΅–Β―¹–Κ–Ψ–Ι ―ç–Ϋ–Β―Ä–≥–Η–Η, –Ω―Ä–Η―Ö–Ψ–¥―è―â–Β–Ι―¹―è –Ϋ–Α –Ψ–¥–Ϋ―É ―΅–Α―¹―²–Η―Ü―É, –Ϋ–Α–Ζ―΄–≤–Α–Β―²―¹―è ―²–Β–Φ–Ω–Β―Ä–Α―²―É―Ä–Ψ–Ι. –ï―¹–Μ–Η ―²–Β–Φ–Ω–Β―Ä–Α―²―É―Ä―É –Η–Ζ–Φ–Β―Ä―è―²―¨ –≤ –ö–Β–Μ―¨–≤–Η–Ϋ–Α―Ö, –Α ―ç–Ϋ–Β―Ä–≥–Η―é –≤ ―¹–Η―¹―²–Β–Φ–Β –Γ–™–Γ (―ç―Ä–≥), ―²–Ψ ―¹―Ä–Β–¥–Ϋ―è―è ―ç–Ϋ–Β―Ä–≥–Η―è, –Ω―Ä–Η―Ö–Ψ–¥―è―â–Α―è―¹―è –Ϋ–Α –Ψ–¥–Ϋ―É –Φ–Ψ–Μ–Β–Κ―É–Μ―É –≥–Α–Ζ–Α, ―¹–Ψ―¹―²–Α–≤–Μ―è–Β―² –½–¥–Β―¹―¨ k = 1,38 times; 10-16 ―ç―Ä–≥/–ö - –Ω–Ψ―¹―²–Ψ―è–Ϋ–Ϋ–Α―è –ë–Ψ–Μ―¨―Ü–Φ–Α–Ϋ–Α. –û–Ϋ–Α –Ω―Ä–Β–¥―¹―²–Α–≤–Μ―è–Β―² ―¹–Ψ–±–Ψ–Ι ―É–Ϋ–Η–≤–Β―Ä―¹–Α–Μ―¨–Ϋ―É―é –≥–Α–Ζ–Ψ–≤―É―é –Ω–Ψ―¹―²–Ψ―è–Ϋ–Ϋ―É―é R, –Ϋ–Ψ ―Ä–Α―¹―¹―΅–Η―²–Α–Ϋ–Ϋ―É―é –Ϋ–Β –Ϋ–Α 1 –Φ–Ψ–Μ―¨, –Α –Ϋ–Α –Ψ–¥–Ϋ―É –Φ–Ψ–Μ–Β–Κ―É–Μ―É, ―².–Β. –£–Β–Μ–Η―΅–Η–Ϋ–Α k –Η–Φ–Β–Β―² –Ψ―΅–Β–Ϋ―¨ –≤–Α–Ε–Ϋ―΄–Ι ―³–Η–Ζ–Η―΅–Β―¹–Κ–Η–Ι ―¹–Φ―΄―¹–Μ. –€―΄ –Ϋ–Β –Φ–Ψ–Ε–Β–Φ ―¹–Κ–Α–Ζ–Α―²―¨, ―¹–Κ–Ψ–Μ―¨–Κ–Ψ –Φ–Ψ–Μ–Β–Κ―É–Μ –≥–Α–Ζ–Α –≤ –¥–Α–Ϋ–Ϋ―΄–Ι –Φ–Ψ–Φ–Β–Ϋ―² –Ψ–±–Μ–Α–¥–Α–Β―² –Κ–Α–Κ–Η–Φ-–Μ–Η–±–Ψ –Ψ–Ω―Ä–Β–¥–Β–Μ–Β–Ϋ–Ϋ―΄–Φ –Ζ–Ϋ–Α―΅–Β–Ϋ–Η–Β–Φ ―ç–Ϋ–Β―Ä–≥–Η–Η, –Ω–Ψ―²–Ψ–Φ―É ―΅―²–Ψ ―ç―²–Ψ –Ζ–Α–≤–Η―¹–Η―² –Ψ―² –Η―Ö ―¹–Μ―É―΅–Α–Ι–Ϋ―΄―Ö ―¹―²–Ψ–Μ–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η–Ι. –û–¥–Ϋ–Α–Κ–Ψ –Φ―΄ –Φ–Ψ–Ε–Β–Φ ―¹–Κ–Α–Ζ–Α―²―¨, –Κ–Α–Κ–Ψ–≤–Α –≤–Β―Ä–Ψ―è―²–Ϋ–Ψ―¹―²―¨ ―²–Ψ–≥–Ψ, ―΅―²–Ψ –Η―Ö ―ç–Ϋ–Β―Ä–≥–Η―è –±–Μ–Η–Ζ–Κ–Α –Κ ―²–Α–Κ–Ψ–Φ―É-―²–Ψ –Ζ–Ϋ–Α―΅–Β–Ϋ–Η―é. –û–Κ–Α–Ζ―΄–≤–Α–Β―²―¹―è, ―΅―²–Ψ k - ―ç―²–Ψ ―Ä–Α―¹―¹―΅–Η―²–Α–Ϋ–Ϋ–Α―è –Ϋ–Α 1¬±–ö –Ϋ–Α–Η–±–Ψ–Μ–Β–Β –≤–Β―Ä–Ψ―è―²–Ϋ–Α―è ―ç–Ϋ–Β―Ä–≥–Η―è –Ψ–¥–Ϋ–Ψ–Ι –Φ–Ψ–Μ–Β–Κ―É–Μ―΄. –Γ–Μ–Β–¥–Ψ–≤–Α―²–Β–Μ―¨–Ϋ–Ψ, –Ω―Ä–Η ―²–Β–Φ–Ω–Β―Ä–Α―²―É―Ä–Β –Δ –±–Ψ–Μ―¨―à–Η–Ϋ―¹―²–≤–Ψ –Φ–Ψ–Μ–Β–Κ―É–Μ –≥–Α–Ζ–Α –¥–Ψ–Μ–Ε–Ϋ–Ψ –Η–Φ–Β―²―¨ ―ç–Ϋ–Β―Ä–≥–Η―é –±–Μ–Η–Ζ–Κ―É―é –Κ –≤–Β–Μ–Η―΅–Η–Ϋ–Β kT. –ï―¹–Μ–Η ―ç―²–Α ―ç–Ϋ–Β―Ä–≥–Η―è ―Ä–Α–≤–Ϋ–Α 1 ―ç–≤, ―²–Ψ ―²–Β–Φ–Ω–Β―Ä–Α―²―É―Ä–Α –≥–Α–Ζ–Α ―¹–Ψ―¹―²–Α–≤–Μ―è–Β―² –≠–Ϋ–Β―Ä–≥–Η―é, –Ψ―²–Μ–Η―΅–Α―é―â―É―é―¹―è –Ψ―² kT –≤ ―²―É –Η–Μ–Η –¥―Ä―É–≥―É―é ―¹―²–Ψ―Ä–Ψ–Ϋ―É –±–Ψ–Μ―¨―à–Β ―΅–Β–Φ –≤ 2 ―Ä–Α–Ζ–Α, –Η–Φ–Β–Β―² –Φ–Β–Ϋ―¨―à–Β –Ω–Ψ–Μ–Ψ–≤–Η–Ϋ―΄ ―΅–Η―¹–Μ–Α –Φ–Ψ–Μ–Β–Κ―É–Μ, –Ϋ–Α―Ö–Ψ–¥―è―â–Η―Ö―¹―è –≤ –Ϋ–Β–Κ–Ψ―²–Ψ―Ä–Ψ–Φ –Ψ–±―ä–Β–Φ–Β –≥–Α–Ζ–Α. –£–Ψ–Ψ–±―â–Β ―΅–Η―¹–Μ–Ψ ―΅–Α―¹―²–Η―Ü, –Η–Φ–Β―é―â–Η―Ö ―ç–Ϋ–Β―Ä–≥–Η―é –≤ –Ω―Ä–Β–¥–Β–Μ–Α―Ö –Ψ―² e¬† –¥–Ψ e¬† + De ,¬† –±―΄―¹―²―Ä–Ψ ―É–±―΄–≤–Α–Β―² –Ω–Ψ –Φ–Β―Ä–Β ―É–≤–Β–Μ–Η―΅–Β–Ϋ–Η―è –Α–±―¹–Ψ–Μ―é―²–Ϋ–Ψ–Ι –≤–Β–Μ–Η―΅–Η–Ϋ―΄ ―Ä–Α–Ζ–Ϋ–Ψ―¹―²–Η | kT - e¬† | . –Δ–Ψ –Ε–Β ―¹–Α–Φ–Ψ–Β –Η–Φ–Β–Β―² –Φ–Β―¹―²–Ψ, –Β―¹–Μ–Η ―Ä–Α―¹―¹–Φ–Α―²―Ä–Η–≤–Α―²―¨ –≤–Φ–Β―¹―²–Ψ ―ç–Ϋ–Β―Ä–≥–Η–Η ―΅–Α―¹―²–Η―Ü –Η―Ö ―¹–Κ–Ψ―Ä–Ψ―¹―²–Η. –û–¥–Ϋ–Α–Κ–Ψ –≤ ―ç―²–Ψ–Φ ―¹–Μ―É―΅–Α–Β ―¹–Μ–Β–¥―É–Β―² ―É―΅–Η―²―΄–≤–Α―²―¨, ―΅―²–Ψ –¥–≤–Η–Ε–Β–Ϋ–Η―è ―΅–Α―¹―²–Η―Ü ―Ä–Α–Ζ–Μ–Η―΅–Α―é―²―¹―è ―²–Α–Κ–Ε–Β –Ϋ–Α–Ω―Ä–Α–≤–Μ–Β–Ϋ–Η–Β–Φ. –†–Α―¹―¹–Φ–Ψ―²―Ä–Η–Φ –Φ–Ψ–Μ–Β–Κ―É–Μ―É, –Ψ–±–Μ–Α–¥–Α―é―â―É―é –Ϋ–Α–Η–±–Ψ–Μ–Β–Β –≤–Β―Ä–Ψ―è―²–Ϋ―΄–Φ –Ζ–Ϋ–Α―΅–Β–Ϋ–Η–Β–Φ –Κ–Η–Ϋ–Β―²–Η―΅–Β―¹–Κ–Ψ–Ι ―ç–Ϋ–Β―Ä–≥–Η–Η kT. –û–Ϋ–Α –¥–Ψ–Μ–Ε–Ϋ–Α –¥–≤–Η–≥–Α―²―¨―¹―è ―¹ –Ϋ–Α–Η–±–Ψ–Μ–Β–Β –≤–Β―Ä–Ψ―è―²–Ϋ–Ψ–Ι ―¹–Κ–Ψ―Ä–Ψ―¹―²―¨―é, ―Ä–Α–≤–Ϋ–Ψ–Ι –Ω–Ψ –Α–±―¹–Ψ–Μ―é―²–Ϋ–Ψ–Ι –≤–Β–Μ–Η―΅–Η–Ϋ–Β –ü―Ä–Β–¥–Ω–Ψ–Μ–Ψ–Ε–Η–Φ, ―΅―²–Ψ –≤―¹–Β –Φ–Ψ–Μ–Β–Κ―É–Μ―΄ –≤ ―¹―Ä–Β–¥–Ϋ–Β–Φ –¥–≤–Η–Ε―É―²―¹―è ―¹–Ψ ―¹–Κ–Ψ―Ä–Ψ―¹―²―è–Φ–Η, ―Ä–Α–≤–Ϋ―΄–Φ–Η –Ω–Ψ –≤–Β–Μ–Η―΅–Η–Ϋ–Β v* . –Δ–Ψ–≥–¥–Α, –Ω–Ψ―¹–Κ–Ψ–Μ―¨–Κ―É –Η―Ö –¥–≤–Η–Ε–Β–Ϋ–Η―è ―Ö–Α–Ψ―²–Η―΅–Ϋ―΄, –≤–Β–Κ―²–Ψ―Ä―΄ ―¹–Κ–Ψ―Ä–Ψ―¹―²–Β–Ι –Ψ―²–¥–Β–Μ―¨–Ϋ―΄―Ö –Φ–Ψ–Μ–Β–Κ―É–Μ –¥–Ψ–Μ–Ε–Ϋ―΄ –Η–Φ–Β―²―¨ –≤―¹–Β–≤–Ψ–Ζ–Φ–Ψ–Ε–Ϋ―΄–Β –Ϋ–Α–Ω―Ä–Α–≤–Μ–Β–Ϋ–Η―è (―Ä–Η―¹. 87, –Α). –£ ―΅–Α―¹―²–Ϋ–Ψ―¹―²–Η, –Ω–Ψ –Ψ―²–Ϋ–Ψ―à–Β–Ϋ–Η―é –Κ –Ϋ–Α–±–Μ―é–¥–Α―²–Β–Μ―é, –Κ–Ψ―²–Ψ―Ä―΄–Ι ―¹–Φ–Ψ―²―Ä–Η―² –Ϋ–Α –≥–Α–Ζ ―¹–Ψ ―¹―²–Ψ―Ä–Ψ–Ϋ―΄, –Ψ–¥–Ϋ–Α –Ω–Ψ–Μ–Ψ–≤–Η–Ϋ–Α –Ψ–±―â–Β–≥–Ψ ―΅–Η―¹–Μ–Α –Φ–Ψ–Μ–Β–Κ―É–Μ –¥–Ψ–Μ–Ε–Ϋ–Α –≤ –¥–Α–Ϋ–Ϋ―΄–Ι –Φ–Ψ–Φ–Β–Ϋ―² –Ω―Ä–Η–±–Μ–Η–Ε–Α―²―¨―¹―è –Κ –Ϋ–Β–Φ―É, –Α –¥―Ä―É–≥–Α―è - ―É–¥–Α–Μ―è―²―¨―¹―è –Ψ―² –Ϋ–Β–≥–Ψ. –½–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Α―è –¥–Ψ–Μ―è –Φ–Ψ–Μ–Β–Κ―É–Μ –¥–Ψ–Μ–Ε–Ϋ–Α –¥–≤–Η–≥–Α―²―¨―¹―è –≤ –Ω–Μ–Ψ―¹–Κ–Ψ―¹―²―è―Ö, –±–Μ–Η–Ζ–Κ–Η―Ö –Κ –Ω–Μ–Ψ―¹–Κ–Ψ―¹―²–Η, –Ω–Β―Ä–Ω–Β–Ϋ–¥–Η–Κ―É–Μ―è―Ä–Ϋ–Ψ–Ι –Κ –Μ―É―΅―É –Ζ―Ä–Β–Ϋ–Η―è. –≠―²–Η –Φ–Ψ–Μ–Β–Κ―É–Μ―΄ –Ω–Ψ―΅―²–Η –Ϋ–Β –Η–Φ–Β―é―² ―¹–Ψ―¹―²–Α–≤–Μ―è―é―â–Β–Ι ―¹–Κ–Ψ―Ä–Ψ―¹―²–Η –≤–¥–Ψ–Μ―¨ –Μ―É―΅–Α –Ζ―Ä–Β–Ϋ–Η―è, –Η –Η―Ö –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤–Ψ –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ –±–Ψ–Μ―¨―à–Β ―΅–Η―¹–Μ–Α –Φ–Ψ–Μ–Β–Κ―É–Μ, –¥–≤–Η–Ε―É―â–Η―Ö―¹―è –≤–¥–Ψ–Μ―¨ –Μ―É―΅–Α –Ζ―Ä–Β–Ϋ–Η―è (―Ä–Η―¹. 87, 6). –ï―¹–Μ–Η ―²–Β–Ω–Β―Ä―¨ ―É―΅–Β―¹―²―¨, ―΅―²–Ψ ―¹–Κ–Ψ―Ä–Ψ―¹―²–Η –Φ–Ψ–Μ–Β–Κ―É–Μ –Ϋ–Β–Ψ–¥–Η–Ϋ–Α–Κ–Ψ–≤―΄ –Ϋ–Β ―²–Ψ–Μ―¨–Κ–Ψ –Ω–Ψ –Ϋ–Α–Ω―Ä–Α–≤–Μ–Β–Ϋ–Η―è–Φ, –Ϋ–Ψ –Η –Ω–Ψ –≤–Β–Μ–Η―΅–Η–Ϋ–Β, ―²–Ψ –Ψ–Κ–Α–Ζ―΄–≤–Α–Β―²―¹―è, ―΅―²–Ψ ―΅–Η―¹–Μ–Ψ ―΅–Α―¹―²–Η―Ü, ―É –Κ–Ψ―²–Ψ―Ä―΄―Ö ―¹–Ψ―¹―²–Α–≤–Μ―è―é―â–Α―è ―¹–Κ–Ψ―Ä–Ψ―¹―²–Η –≤–¥–Ψ–Μ―¨ –Μ―É―΅–Α –Ζ―Ä–Β–Ϋ–Η―è –Ζ–Α–Κ–Μ―é―΅–Β–Ϋ–Α –≤ –Ω―Ä–Β–¥–Β–Μ–Α―Ö –Ψ―² v–≥¬† –¥–Ψ vr¬† + dvr , –Ω―Ä–Ψ–Ω–Ψ―Ä―Ü–Η–Ψ–Ϋ–Α–Μ―¨–Ϋ–Ψ ―ç–Κ―¹–Ω–Ψ–Ϋ–Β–Ϋ―²–Β¬†¬† ―²–Α–Κ ―΅―²–Ψ –≥–¥–Β –Β = 2,718... - –Ψ―¹–Ϋ–Ψ–≤–Α–Ϋ–Η–Β –Ϋ–Α―²―É―Ä–Α–Μ―¨–Ϋ―΄―Ö –Μ–Ψ–≥–Α―Ä–Η―³–Φ–Ψ–≤, –Α –Ω - –Ψ–±―â–Β–Β ―΅–Η―¹–Μ–Ψ –Φ–Ψ–Μ–Β–Κ―É–Μ –≤ 1 ―¹–Φ2. –≠―²–Ψ - –Ζ–Α–Κ–Ψ–Ϋ ―Ä–Α―¹–Ω―Ä–Β–¥–Β–Μ–Β–Ϋ–Η―è –€–Α–Κ―¹–≤–Β–Μ–Μ–Α. –î–Μ―è –Ω―Ä–Η–±–Μ–Η–Ε–Β–Ϋ–Ϋ–Ψ–≥–Ψ ―Ä–Β―à–Β–Ϋ–Η―è –Φ–Ϋ–Ψ–≥–Η―Ö –Α―¹―²―Ä–Ψ–Ϋ–Ψ–Φ–Η―΅–Β―¹–Κ–Η―Ö –Ζ–Α–¥–Α―΅ –Φ–Ψ–Ε–Ϋ–Ψ –Η―¹―Ö–Ψ–¥–Η―²―¨ –Η–Ζ –Ω―Ä–Β–¥–Ω–Ψ–Μ–Ψ–Ε–Β–Ϋ–Η―è, ―΅―²–Ψ –≤―¹–Β ―΅–Α―¹―²–Η―Ü―΄ –Η–Φ–Β―é―² –Ψ–¥–Η–Ϋ–Α–Κ–Ψ–≤―΄–Β ―ç–Ϋ–Β―Ä–≥–Η–Η, ―Ä–Α–≤–Ϋ―΄–Β kT, –Η –≤ ―¹―Ä–Β–¥–Ϋ–Β–Φ –¥–≤–Η–Ε―É―²―¹―è ―¹ –Ψ–¥–Η–Ϋ–Α–Κ–Ψ–≤―΄–Φ–Η –Ω–Ψ –≤–Β–Μ–Η―΅–Η–Ϋ–Β –Ϋ–Α–Η–±–Ψ–Μ–Β–Β –≤–Β―Ä–Ψ―è―²–Ϋ―΄–Φ–Η ―¹–Κ–Ψ―Ä–Ψ―¹―²―è–Φ–Η v* , –Ψ–Ω―Ä–Β–¥–Β–Μ―è–Β–Φ―΄–Φ–Η ―¹–Ψ–Ψ―²–Ϋ–Ψ―à–Β–Ϋ–Η–Β–Φ (7.14). –û–Ϋ–Η –Ψ―΅–Β–Ϋ―¨ –±–Μ–Η–Ζ–Κ–Η –Κ ―¹―Ä–Β–¥–Ϋ–Β–Κ–≤–Α–¥―Ä–Α―²–Η―΅–Ϋ–Ψ–Ι ―¹–Κ–Ψ―Ä–Ψ―¹―²–Η –Κ–Ψ―²–Ψ―Ä―É―é –Η–Φ–Β–Β―² –Φ–Ψ–Μ–Β–Κ―É–Μ–Α, –Ψ–±–Μ–Α–¥–Α―é―â–Α―è ―¹―Ä–Β–¥–Ϋ–Η–Φ –¥–Μ―è –≤―¹–Β―Ö ―΅–Α―¹―²–Η―Ü –Ζ–Ϋ–Α―΅–Β–Ϋ–Η–Β–Φ ―ç–Ϋ–Β―Ä–≥–Η–Η –£―΄―Ä–Ψ–Ε–¥–Β–Ϋ–Ϋ―΄–Ι –≥–Α–Ζ. –ü―Ä–Η ―É–≤–Β–Μ–Η―΅–Β–Ϋ–Η–Η ―΅–Η―¹–Μ–Α ―΅–Α―¹―²–Η―Ü –≤ –Η–¥–Β–Α–Μ―¨–Ϋ–Ψ–Φ –≥–Α–Ζ–Β –Η―Ö ―Ä–Α―¹–Ω―Ä–Β–¥–Β–Μ–Β–Ϋ–Η–Β –Ω–Ψ ―¹–Κ–Ψ―Ä–Ψ―¹―²―è–Φ ―¹–Ψ―Ö―Ä–Α–Ϋ―è–Β―² ―³–Ψ―Ä–Φ―É –Ω―Ä–Β―Ä―΄–≤–Η―¹―²–Ψ–Ι –Κ―Ä–Η–≤–Ψ–Ι –Ϋ–Α ―Ä–Η―¹. 87, –±. –†–Α―¹―²–Β―² ―²–Ψ–Μ―¨–Κ–Ψ –Ω–Μ–Ψ―â–Α–¥―¨, –Ψ–≥―Ä–Α–Ϋ–Η―΅–Η–≤–Α–Β–Φ–Α―è ―ç―²–Ψ–Ι –Κ―Ä–Η–≤–Ψ–Ι: –Ψ–Ϋ–Α –Ω―Ä–Ψ–Ω–Ψ―Ä―Ü–Η–Ψ–Ϋ–Α–Μ―¨–Ϋ–Α –Ω–Ψ–Μ–Ϋ–Ψ–Φ―É ―΅–Η―¹–Μ―É ―΅–Α―¹―²–Η―Ü. –û–¥–Ϋ–Α–Κ–Ψ –Κ–Ψ–≥–¥–Α –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤–Ψ ―΅–Α―¹―²–Η―Ü –≤ –Ζ–Α–¥–Α–Ϋ–Ϋ–Ψ–Φ –Η–Ϋ―²–Β―Ä–≤–Α–Μ–Β ―¹–Κ–Ψ―Ä–Ψ―¹―²–Β–Ι –Ψ–Κ–Α–Ζ―΄–≤–Α–Β―²―¹―è ―¹–Μ–Η―à–Κ–Ψ–Φ –±–Ψ–Μ―¨―à–Η–Φ, –Ϋ–Α―¹―²―É–Ω–Α–Β―² –Ψ–≥―Ä–Α–Ϋ–Η―΅–Β–Ϋ–Η–Β, –Ϋ–Α–Κ–Μ–Α–¥―΄–≤–Α–Β–Φ–Ψ–Β –Ζ–Α–Κ–Ψ–Ϋ–Α–Φ–Η –Κ–≤–Α–Ϋ―²–Ψ–≤–Ψ–Ι –Φ–Β―Ö–Α–Ϋ–Η–Κ–Η, –Ϋ–Α–Ζ―΄–≤–Α–Β–Φ–Ψ–Β –≤―΄―Ä–Ψ–Ε–¥–Β–Ϋ–Η–Β–Φ. –û–Ϋ–Ψ ―¹–≤―è–Ζ–Α–Ϋ–Ψ ―¹ ―²–Β–Φ, ―΅―²–Ψ –Η–Φ–Ω―É–Μ―¨―¹―΄ ―΅–Α―¹―²–Η―Ü –Φ–Ψ–≥―É―² –Ω―Ä–Η–Ϋ–Η–Φ–Α―²―¨ ―²–Ψ–Μ―¨–Κ–Ψ –¥–Η―¹–Κ―Ä–Β―²–Ϋ―΄–Β –Ζ–Ϋ–Α―΅–Β–Ϋ–Η―è, –Α ―¹–Μ–Η―à–Κ–Ψ–Φ –±–Μ–Η–Ζ–Κ–Η―Ö ―΅–Α―¹―²–Η―Ü ―¹ –Ψ–¥–Η–Ϋ–Α–Κ–Ψ–≤―΄–Φ–Η –Η–Φ–Ω―É–Μ―¨―¹–Α–Φ–Η –±―΄―²―¨ –Ϋ–Β –Φ–Ψ–Ε–Β―² (–Ω―Ä–Η–Ϋ―Ü–Η–Ω –ü–Α―É–Μ–Η). –ü–Ψ―ç―²–Ψ–Φ―É –Ϋ–Α―΅–Η–Ϋ–Α―è ―¹ –Ϋ–Β–Κ–Ψ―²–Ψ―Ä―΄―Ö –Ζ–Ϋ–Α―΅–Β–Ϋ–Η–Ι –Ω–Μ–Ψ―²–Ϋ–Ψ―¹―²–Η (–Ω―Ä–Η T = 107 ¬±K ―ç―²–Ψ 103 –≥/―¹–Φ3), –¥–Α–Μ―¨–Ϋ–Β–Ι―à–Β–Β –Β–Β ―É–≤–Β–Μ–Η―΅–Β–Ϋ–Η–Β –Ω―Ä–Ψ–Η―¹―Ö–Ψ–¥–Η―² –Ζ–Α ―¹―΅–Β―² –Ω–Ψ–Ω–Ψ–Μ–Ϋ–Β–Ϋ–Η―è –Ψ–±–Μ–Α―¹―²–Η –±–Ψ–Μ–Β–Β –±―΄―¹―²―Ä―΄―Ö ―΅–Α―¹―²–Η―Ü. –ü―Ä–Η –Ω–Ψ–Μ–Ϋ–Ψ–Φ –≤―΄―Ä–Ψ–Ε–¥–Β–Ϋ–Η–Η ―Ä–Α―¹–Ω―Ä–Β–¥–Β–Μ–Β–Ϋ–Η–Β ―¹―²–Α–Ϋ–Ψ–≤–Η―²―¹―è –Ω–Μ–Ψ―¹–Κ–Η–Φ (―¹–Ω–Μ–Ψ―à–Ϋ–Α―è –Κ―Ä–Η–≤–Α―è –Ϋ–Α ―Ä–Η―¹. 87,6). –Δ–Β–Φ ―¹–Α–Φ―΄–Φ ―¹―É–Φ–Φ–Α―Ä–Ϋ―΄–Ι –Η–Φ–Ω―É–Μ―¨―¹ –Β–¥–Η–Ϋ–Η―Ü―΄ –Ψ–±―ä–Β–Φ–Α (―².–Β. –¥–Α–≤–Μ–Β–Ϋ–Η–Β) –Ω–Β―Ä–Β―¹―²–Α–Β―² –Ζ–Α–≤–Η―¹–Β―²―¨ –Ψ―² ―²–Β–Φ–Ω–Β―Ä–Α―²―É―Ä―΄ –Η –Ψ–Ω―Ä–Β–¥–Β–Μ―è–Β―²―¹―è ―²–Ψ–Μ―¨–Κ–Ψ –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η–Β–Ι ―΅–Α―¹―²–Η―Ü (―².–Β. –Ω–Μ–Ψ―²–Ϋ–Ψ―¹―²―¨―é). –Γ–Κ–Ψ―Ä–Ψ―¹―²―¨ ―΅–Α―¹―²–Η―Ü, ―¹–Μ–Β–¥–Ψ–≤–Α―²–Β–Μ―¨–Ϋ–Ψ, ―²–Α–Κ–Ε–Β ―Ä–Α―¹―²–Β―² ―¹ –Ω–Μ–Ψ―²–Ϋ–Ψ―¹―²―¨―é. –£ –Κ–≤–Α–Ϋ―²–Ψ–≤–Ψ–Ι ―¹―²–Α―²–Η―¹―²–Η–Κ–Β –¥–Μ―è ―É―Ä–Α–≤–Ϋ–Β–Ϋ–Η―è ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η―è –≤―΄―Ä–Ψ–Ε–¥–Β–Ϋ–Ϋ–Ψ–≥–Ψ –≥–Α–Ζ–Α –≤–Φ–Β―¹―²–Ψ ―³–Ψ―Ä–Φ―É–Μ―΄ (7.9) –Ω–Ψ–Μ―É―΅–Α–Β―²―¹―è –Ζ–Α–≤–Η―¹–Η–Φ–Ψ―¹―²―¨ –† ~ r 5/3. –ü–Ψ–Ϋ―è―²–Η–Β –Ψ–± ―ç–Μ–Β–Φ–Β–Ϋ―²–Α―Ä–Ϋ―΄―Ö –Ω―Ä–Ψ―Ü–Β―¹―¹–Α―Ö. –£ –Α―¹―²―Ä–Ψ―³–Η–Ζ–Η–Κ–Β –Ψ―¹–Ψ–±–Ψ–Β –Ζ–Ϋ–Α―΅–Β–Ϋ–Η–Β –Η–Φ–Β–Β―² –Α–Ϋ–Α–Μ–Η–Ζ ―²–Α–Κ –Ϋ–Α–Ζ―΄–≤–Α–Β–Φ―΄―Ö ―ç–Μ–Β–Φ–Β–Ϋ―²–Α―Ä–Ϋ―΄―Ö –Ω―Ä–Ψ―Ü–Β―¹―¹–Ψ–≤, ―¹–≤―è–Ζ–Α–Ϋ–Ϋ―΄―Ö ―¹ –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η–Β–Φ ―ç–Ϋ–Β―Ä–≥–Η–Η –Α―²–Ψ–Φ–Ψ–≤, –Ω–Ψ–Ζ–≤–Ψ–Μ―è―é―â–Η–Ι ―É―¹―²–Α–Ϋ–Ψ–≤–Η―²―¨ –Ζ–Α–≤–Η―¹–Η–Φ–Ψ―¹―²―¨ –Φ–Β–Ε–¥―É ―²–Β–Ω–Μ–Ψ–≤–Ψ–Ι ―ç–Ϋ–Β―Ä–≥–Η–Β–Ι –≥–Α–Ζ–Α –Η –Β–≥–Ψ –Η–Ζ–Μ―É―΅–Β–Ϋ–Η–Β–Φ. –ü―Ä–Β–Ε–¥–Β –≤―¹–Β–≥–Ψ –≤–Α–Ε–Ϋ–Ψ –Ζ–Ϋ–Α―²―¨, –Κ–Α–Κ ―΅–Α―¹―²–Ψ ―¹―²–Α–Μ–Κ–Η–≤–Α―é―²―¹―è –Φ–Β–Ε–¥―É ―¹–Ψ–±–Ψ–Ι ―΅–Α―¹―²–Η―Ü―΄ –≥–Α–Ζ–Α. –Γ–Ϋ–Α―΅–Α–Μ–Α ―Ä–Α―¹―¹–Φ–Ψ―²―Ä–Η–Φ ―É–Ω―Ä–Ψ―â–Β–Ϋ–Ϋ―΄–Ι ―¹–Μ―É―΅–Α–Ι: –¥–≤–Η–Ε–Β―²―¹―è –Ψ–¥–Ϋ–Α –±–Ψ–Μ―¨―à–Α―è –Φ–Ψ–Μ–Β–Κ―É–Μ–Α, –Η–Φ–Β―é―â–Α―è –≤–Η–¥ ―à–Α―Ä–Η–Κ–Α ―¹ –Ω–Ψ–Ω–Β―Ä–Β―΅–Ϋ―΄–Φ ―¹–Β―΅–Β–Ϋ–Η–Β–Φ s , –Α –≤―¹–Β –Ψ―¹―²–Α–Μ―¨–Ϋ―΄–Β –Φ–Ψ–Ε–Ϋ–Ψ ―¹―΅–Η―²–Α―²―¨ –Ϋ–Β–Ω–Ψ–¥–≤–Η–Ε–Ϋ―΄–Φ–Η ―²–Ψ―΅–Κ–Α–Φ–Η. –ü―É―¹―²―¨ –Ω―Ä–Η ―ç―²–Ψ–Φ –≤–Ζ–Α–Η–Φ–Ψ–¥–Β–Ι―¹―²–≤–Η―è –Ω―Ä–Ψ–Η―¹―Ö–Ψ–¥―è―² –≤―¹―è–Κ–Η–Ι ―Ä–Α–Ζ, –Κ–Ψ–≥–¥–Α –Ϋ–Α –Ω―É―²–Η –±–Ψ–Μ―¨―à–Ψ–Ι –Φ–Ψ–Μ–Β–Κ―É–Μ―΄. –≤―¹―²―Ä–Β―΅–Α–Β―²―¹―è –Κ–Α–Κ–Α―è-–Ϋ–Η–±―É–¥―¨ –¥―Ä―É–≥–Α―è. –Δ–Ψ–≥–¥–Α –Ψ–Ϋ–Α –Φ–Ψ–Ε–Β―² –¥–≤–Η–≥–Α―²―¨―¹―è –±–Β–Ζ ―¹―²–Ψ–Μ–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η―è ―²–Ψ–Μ―¨–Κ–Ψ –¥–Ψ ―²–Β―Ö –Ω–Ψ―Ä, –Ω–Ψ–Κ–Α –Ϋ–Β –Ω―Ä–Ψ–Ι–¥–Β―² ―¹–≤–Ψ–±–Ψ–¥–Ϋ–Ψ–≥–Ψ –Ψ–±―ä–Β–Φ–Α, –Ω―Ä–Η―Ö–Ψ–¥―è―â–Β–≥–Ψ―¹―è –Ϋ–Α –Ψ–¥–Ϋ―É ―΅–Α―¹―²–Η―Ü―É. –ï―¹–Μ–Η –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η―è –Φ–Ψ–Μ–Β–Κ―É–Μ –Ω ―΅–Α―¹―²–Η―Ü/―¹–Φ3, ―²–Ψ –Ϋ–Α –Κ–Α–Ε–¥―É―é –Η–Ζ –Ϋ–Η―Ö –≤ ―¹―Ä–Β–¥–Ϋ–Β–Φ –Ω―Ä–Η―Ö–Ψ–¥–Η―²―¹―è –Ψ–±―ä–Β–Φ –Ω―Ä–Ψ―¹―²―Ä–Α–Ϋ―¹―²–≤–Α¬† ―¹–Φ3. –ß–Α―¹―²–Η―Ü–Α ―¹ –Ω–Ψ–Ω–Β―Ä–Β―΅–Ϋ―΄–Φ ―¹–Β―΅–Β–Ϋ–Η–Β–Φ s,¬† –¥–≤–Η–≥–Α―è―¹―¨ ―¹–Ψ ―¹–Κ–Ψ―Ä–Ψ―¹―²―¨―é v*, –Ω―Ä–Ψ–Ι–¥–Β―² ―²–Α–Κ–Ψ–Ι –Ψ–±―ä–Β–Φ –Ζ–Α –≤―Ä–Β–Φ―è –≠―²–Ψ –¥–Α–Β―² ―¹―Ä–Β–¥–Ϋ–Η–Ι –Ω―Ä–Ψ–Φ–Β–Ε―É―²–Ψ–Κ –≤―Ä–Β–Φ–Β–Ϋ–Η –Φ–Β–Ε–¥―É –¥–≤―É–Φ―è –Ω–Ψ―¹–Μ–Β–¥–Ψ–≤–Α―²–Β–Μ―¨–Ϋ―΄–Φ–Η ―¹―²–Ψ–Μ–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η―è–Φ–Η. –û–±―Ä–Α―²–Ϋ–Α―è –≤–Β–Μ–Η―΅–Η–Ϋ–Α –Ω–Ψ–Κ–Α–Ζ―΄–≤–Α–Β―², ―¹–Κ–Ψ–Μ―¨–Κ–Ψ ―¹―²–Ψ–Μ–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η–Ι –Ω―Ä–Ψ–Η―¹―Ö–Ψ–¥–Η―² –≤ ―¹―Ä–Β–¥–Ϋ–Β–Φ –Ζ–Α 1 ―¹–Β–Κ, –Η –Ϋ–Α–Ζ―΄–≤–Α–Β―²―¹―è ―΅–Α―¹―²–Ψ―²–Ψ–Ι ―¹―²–Ψ–Μ–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η–Ι –ü―É―²―¨, –Ω―Ä–Ψ―Ö–Ψ–¥–Η–Φ―΄–Ι ―΅–Α―¹―²–Η―Ü–Β–Ι –Φ–Β–Ε–¥―É –Ω–Ψ―¹–Μ–Β–¥–Ψ–≤–Α―²–Β–Μ―¨–Ϋ―΄–Φ–Η ―¹―²–Ψ–Μ–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η―è–Φ–Η, –Ϋ–Α–Ζ―΄–≤–Α–Β―²―¹―è –¥–Μ–Η–Ϋ–Ψ–Ι ―¹–≤–Ψ–±–Ψ–¥–Ϋ–Ψ–≥–Ψ –Ω―Ä–Ψ–±–Β–≥–Α, –Κ–Ψ―²–Ψ―Ä–Α―è, –Ψ―΅–Β–≤–Η–¥–Ϋ–Ψ, ―Ä–Α–≤–Ϋ–Α –Δ–Α–Κ –Κ–Α–Κ –Ψ―¹―²–Α–Μ―¨–Ϋ―΄–Β ―΅–Α―¹―²–Η―Ü―΄ –≤ ―¹―Ä–Β–¥–Ϋ–Β–Φ ―²–Ψ–Ε–Β –Η–Φ–Β―é―² –Ω–Ψ–Ω–Β―Ä–Β―΅–Ϋ–Η–Κ–Η s , –Α –Ω–Μ–Ψ―â–Α–¥―¨ –Ω―Ä–Ψ–Ω–Ψ―Ä―Ü–Η–Ψ–Ϋ–Α–Μ―¨–Ϋ–Α –Κ–≤–Α–¥―Ä–Α―²―É ―Ä–Α–¥–Η―É―¹–Α, ―²–Ψ –≤–Φ–Β―¹―²–Ψ s –≤ –≤―΄–≤–Β–¥–Β–Ϋ–Ϋ―΄–Β ―³–Ψ―Ä–Φ―É–Μ―΄ –Ϋ–Α–¥–Ψ –Ω–Ψ–¥―¹―²–Α–≤–Η―²―¨ –≤–Β–Μ–Η―΅–Η–Ϋ―É –≤ 4 ―Ä–Α–Ζ–Α –±–Ψ–Μ―¨―à―É―é. –ö―Ä–Ψ–Φ–Β ―²–Ψ–≥–Ψ, ―É―΅–Β―² –¥–≤–Η–Ε–Β–Ϋ–Η–Ι –≤―¹–Β―Ö ―΅–Α―¹―²–Η―Ü, –Β―¹–Μ–Η –Ψ–Ϋ–Η –Ψ–¥–Η–Ϋ–Α–Κ–Ψ–≤―΄, –¥–Α–Β―² ―É–≤–Β–Μ–Η―΅–Β–Ϋ–Η–Β –Β―â–Β –≤¬† ―Ä–Α–Ζ. –û–¥–Ϋ–Α–Κ–Ψ –Φ―΄ –Ϋ–Β –±―É–¥–Β–Φ –≤–≤–Ψ–¥–Η―²―¨ ―ç―²–Η―Ö ―É―²–Ψ―΅–Ϋ–Β–Ϋ–Η–Ι –≤ –Ω–Ψ–Μ―É―΅–Β–Ϋ–Ϋ―΄–Β –≤―΄―à–Β ―³–Ψ―Ä–Φ―É–Μ―΄, ―²–Α–Κ –Κ–Α–Κ –≥–Ψ―Ä–Α–Ζ–¥–Ψ ―¹―É―â–Β―¹―²–≤–Β–Ϋ–Ϋ–Β–Β, ―΅―²–Ψ –¥–Μ―è –Φ–Η–Κ―Ä–Ψ―΅–Α―¹―²–Η―Ü (–Α―²–Ψ–Φ―΄, –Η–Ψ–Ϋ―΄, ―¹–≤–Ψ–±–Ψ–¥–Ϋ―΄–Β ―ç–Μ–Β–Κ―²―Ä–Ψ–Ϋ―΄) –Ω―Ä–Β–¥―¹―²–Α–≤–Μ–Β–Ϋ–Η–Β –Ψ –≥–Β–Ψ–Φ–Β―²―Ä–Η―΅–Β―¹–Κ–Η―Ö ―Ä–Α–Ζ–Φ–Β―Ä–Α―Ö –≤–Ψ–Ψ–±―â–Β ―²–Β―Ä―è–Β―² ―¹–Φ―΄―¹–Μ. –ü–Ψ―ç―²–Ψ–Φ―É ―³–Ψ―Ä–Φ―É–Μ―΄ (7.17)-(7.19) –Η–Φ–Β―é―² ―¹–Φ―΄―¹–Μ ―²–Ψ–Μ―¨–Κ–Ψ –≤ ―²–Ψ–Φ ―¹–Μ―É―΅–Α–Β, –Β―¹–Μ–Η –Ω–Ψ–¥ –≤–Β–Μ–Η―΅–Η–Ϋ–Ψ–Ι –Α –Ω–Ψ–Ϋ–Η–Φ–Α―²―¨ –Μ–Η―à―¨ –Ϋ–Β–Κ–Ψ―²–Ψ―Ä―΄–Ι –Ω–Α―Ä–Α–Φ–Β―²―Ä, ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Η–Ζ―É―é―â–Η–Ι –≤–Β―Ä–Ψ―è―²–Ϋ–Ψ―¹―²―¨ ―²–Ψ–≥–Ψ, ―΅―²–Ψ –Ω―Ä–Ψ–Η–Ζ–Ψ–Ι–¥–Β―² ―¹–±–Μ–Η–Ε–Β–Ϋ–Η–Β ―Ä–Α―¹―¹–Φ–Α―²―Ä–Η–≤–Α–Β–Φ―΄―Ö ―΅–Α―¹―²–Η―Ü, –Κ–Ψ―²–Ψ―Ä–Ψ–Β –Ζ–Α–≤–Β―Ä―à–Η―²―¹―è –¥–Α–Ϋ–Ϋ―΄–Φ ―è–≤–Μ–Β–Ϋ–Η–Β–Φ. –Δ–Α–Κ–Η–Φ ―è–≤–Μ–Β–Ϋ–Η–Β–Φ –Φ–Ψ–Ε–Β―², –Ϋ–Α–Ω―Ä–Η–Φ–Β―Ä, –±―΄―²―¨ ―É–Ω―Ä―É–≥–Ψ–Β ―¹―²–Ψ–Μ–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η–Β ―¹ –Ω―Ä–Ψ―¹―²―΄–Φ –Ω–Β―Ä–Β―Ä–Α―¹–Ω―Ä–Β–¥–Β–Μ–Β–Ϋ–Η–Β–Φ –Κ–Η–Ϋ–Β―²–Η―΅–Β―¹–Κ–Ψ–Ι ―ç–Ϋ–Β―Ä–≥–Η–Η, –Η–Μ–Η ―¹―²–Ψ–Μ–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η–Β, –Ω―Ä–Η –Κ–Ψ―²–Ψ―Ä–Ψ–Φ –Ψ–Ω―Ä–Β–¥–Β–Μ–Β–Ϋ–Ϋ―΄–Φ –Ψ–±―Ä–Α–Ζ–Ψ–Φ –Ω―Ä–Ψ–Η–Ζ–Ψ–Ι–¥–Β―² –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η–Β –≤–Ϋ―É―²―Ä–Β–Ϋ–Ϋ–Β–Ι ―ç–Ϋ–Β―Ä–≥–Η–Η –Φ–Ψ–Μ–Β–Κ―É–Μ―΄ –Η–Μ–Η –Α―²–Ψ–Φ–Α –Η ―².–¥. –ö–Α–Κ –Φ―΄ –≤–Η–¥–Η–Φ, ―ç―²–Ψ―² –Ω–Α―Ä–Α–Φ–Β―²―Ä –Η–Φ–Β–Β―² ―Ä–Α–Ζ–Φ–Β―Ä–Ϋ–Ψ―¹―²―¨ –Ω–Μ–Ψ―â–Α–¥–Η –Η –Ω–Ψ―²–Ψ–Φ―É –Ϋ–Α–Ζ―΄–≤–Α–Β―²―¹―è ―ç―³―³–Β–Κ―²–Η–≤–Ϋ―΄–Φ ―¹–Β―΅–Β–Ϋ–Η–Β–Φ. –û–Ϋ –Ω–Ψ–Κ–Α–Ζ―΄–≤–Α–Β―², ―΅―²–Ψ –≤ –¥–Α–Ϋ–Ϋ–Ψ–Φ –Ω―Ä–Ψ―Ü–Β―¹―¹–Β ―Ä–Α―¹―¹–Φ–Α―²―Ä–Η–≤–Α–Β–Φ–Α―è ―΅–Α―¹―²–Η―Ü–Α –≤–Β–¥–Β―² ―¹–Β–±―è ―²–Α–Κ –Ε–Β, –Κ–Α–Κ –Β―¹–Μ–Η –±―΄ –Ψ–Ϋ–Α –Η–Φ–Β–Μ–Α –≥–Β–Ψ–Φ–Β―²―Ä–Η―΅–Β―¹–Κ–Η–Ι –Ω–Ψ–Ω–Β―Ä–Β―΅–Ϋ–Η–Κ s,¬† –Α ―΅–Α―¹―²–Η―Ü―΄, ―¹ –Κ–Ψ―²–Ψ―Ä―΄–Φ–Η –Ψ–Ϋ–Α –≤–Ζ–Α–Η–Φ–Ψ–¥–Β–Ι―¹―²–≤―É–Β―², - –±―΄–Μ–Η –±―΄ –Ϋ–Β–Ω–Ψ–¥–≤–Η–Ε–Ϋ―΄–Φ–Η ―²–Ψ―΅–Κ–Α–Φ–Η. –Δ–Α–Κ, –Ϋ–Α–Ω―Ä–Η–Φ–Β―Ä, –¥–Μ―è ―¹―²–Ψ–Μ–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η–Ι –Φ–Ψ–Μ–Β–Κ―É–Μ –≤ –≤–Ψ–Ζ–¥―É―Ö–Β –Ω―Ä–Η –Ψ–±―΄―΅–Ϋ―΄―Ö ―É―¹–Μ–Ψ–≤–Η―è―Ö ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ–Β ―¹–Β―΅–Β–Ϋ–Η–Β –Ψ–Κ–Ψ–Μ–Ψ 10-14 ―¹–Φ2. –Γ–≤–Ψ–±–Ψ–¥–Ϋ―΄–Β ―ç–Μ–Β–Κ―²―Ä–Ψ–Ϋ―΄ –≤ –≥–Α–Ζ–Β –Ω―Ä–Η –≤―΄―¹–Ψ–Κ–Η―Ö ―²–Β–Φ–Ω–Β―Ä–Α―²―É―Ä–Α―Ö, ―¹―²–Α–Μ–Κ–Η–≤–Α―è―¹―¨ ―¹ –Ϋ–Β–Ι―²―Ä–Α–Μ―¨–Ϋ―΄–Φ–Η –Α―²–Ψ–Φ–Α–Φ–Η, –Φ–Ψ–≥―É―² –Ψ―²―Ä―΄–≤–Α―²―¨ –Ψ―² –Ϋ–Η―Ö ―ç–Μ–Β–Κ―²―Ä–Ψ–Ϋ―΄ (–Η–Ψ–Ϋ–Η–Ζ–Ψ–≤–Α―²―¨). –≠―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ–Β ―¹–Β―΅–Β–Ϋ–Η–Β ―ç―²–Ψ–≥–Ψ –Ω―Ä–Ψ―Ü–Β―¹―¹–Α –Ω―Ä–Η ―²–Β–Φ–Ω–Β―Ä–Α―²―É―Ä–Β 10 000¬± –¥–Μ―è –≤–Ψ–¥–Ψ―Ä–Ψ–¥–Α –Ω–Ψ―Ä―è–¥–Κ–Α 10-16 ―¹–Φ2. –£―¹―²―Ä–Β―²–Η–≤ –Η–Ψ–Ϋ–Η–Ζ–Ψ–≤–Α–Ϋ–Ϋ―΄–Ι –Α―²–Ψ–Φ, ―¹–≤–Ψ–±–Ψ–¥–Ϋ―΄–Ι ―ç–Μ–Β–Κ―²―Ä–Ψ–Ϋ –Φ–Ψ–Ε–Β―² –±―΄―²―¨ –Ζ–Α―Ö–≤–Α―΅–Β–Ϋ –Η–Φ –Η –≤–Β―Ä–Ϋ―É―²―¨―¹―è –Ϋ–Α –Ω―Ä–Β–Ε–Ϋ–Β–Β –Φ–Β―¹―²–Ψ (―Ä–Β–Κ–Ψ–Φ–±–Η–Ϋ–Α―Ü–Η―è). –î–Μ―è ―ç―²–Ψ–≥–Ψ –Ω―Ä–Ψ―Ü–Β―¹―¹–Α ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ–Β ―¹–Β―΅–Β–Ϋ–Η–Β –Ω―Ä–Η ―²–Β―Ö –Ε–Β –Ζ–Ϋ–Α―΅–Β–Ϋ–Η―è―Ö ―²–Β–Φ–Ω–Β―Ä–Α―²―É―Ä―΄ –Ω–Ψ―Ä―è–¥–Κ–Α 10-21 ―¹–Φ2. –ß―²–Ψ–±―΄ –Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α―²―¨―¹―è ―³–Ψ―Ä–Φ―É–Μ–Α–Φ–Η (7.17)-(7.19), –Ϋ–Α–¥–Ψ –Ω―Ä–Β–¥–≤–Α―Ä–Η―²–Β–Μ―¨–Ϋ–Ψ –Ω–Ψ ―³–Ψ―Ä–Φ―É–Μ–Β (7.14) –≤―΄―΅–Η―¹–Μ–Η―²―¨ –Ϋ–Α–Η–±–Ψ–Μ–Β–Β –≤–Β―Ä–Ψ―è―²–Ϋ―É―é ―¹–Κ–Ψ―Ä–Ψ―¹―²―¨ v*, –Κ–Ψ―²–Ψ―Ä―É―é –Η–Φ–Β–Β―² ―Ä–Α―¹―¹–Φ–Α―²―Ä–Η–≤–Α–Β–Φ–Α―è ―΅–Α―¹―²–Η―Ü–Α –Ω―Ä–Η –¥–Α–Ϋ–Ϋ–Ψ–Ι ―²–Β–Φ–Ω–Β―Ä–Α―²―É―Ä–Β. –€–Ψ–Μ–Β–Κ―É–Μ―΄ –≤–Ψ–Ζ–¥―É―Ö–Α –¥–≤–Η–Ε―É―²―¹―è –≤ ―¹―Ä–Β–¥–Ϋ–Β–Φ ―¹–Ψ ―¹–Κ–Ψ―Ä–Ψ―¹―²―¨―é 400 –Φ/―¹–Β–Κ, –Α –≤–Ψ–¥–Ψ―Ä–Ψ–¥–Ϋ―΄–Β –Α―²–Ψ–Φ―΄ –Ω―Ä–Η ―²–Β–Φ–Ω–Β―Ä–Α―²―É―Ä–Β 10 000 ¬±K - ―¹–Ψ ―¹–Κ–Ψ―Ä–Ψ―¹―²―¨―é –Ψ–Κ–Ψ–Μ–Ψ 10 –Κ–Φ/―¹–Β–Κ. –Γ―Ä–Β–¥–Ϋ―è―è ―ç–Ϋ–Β―Ä–≥–Η―è ―΅–Α―¹―²–Η―Ü –Ψ–¥–Η–Ϋ–Α–Κ–Ψ–≤–Α. –ü–Ψ―ç―²–Ψ–Φ―É –±–Ψ–Μ–Β–Β –Μ–Β–≥–Κ–Η–Β ―¹–≤–Ψ–±–Ψ–¥–Ϋ―΄–Β ―ç–Μ–Β–Κ―²―Ä–Ψ–Ϋ―΄ –¥–≤–Η–Ε―É―²―¹―è –≤ 37 ―Ä–Α–Ζ –±―΄―¹―²―Ä–Β–Β –Α―²–Ψ–Φ–Ψ–≤ –≤–Ψ–¥–Ψ―Ä–Ψ–¥–Α. –ü―Ä–Η –Ϋ–Ψ―Ä–Φ–Α–Μ―¨–Ϋ―΄―Ö ―É―¹–Μ–Ψ–≤–Η―è―Ö –≤ –≤–Ψ–Ζ–¥―É―Ö–Β ―¹―²–Ψ–Μ–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η―è –Ψ―΅–Β–Ϋ―¨ ―΅–Α―¹―²―΄ (–Ψ–Κ–Ψ–Μ–Ψ –¥–Β―¹―è―²–Η –Φ–Η–Μ–Μ–Η–Α―Ä–¥–Ψ–≤ –≤ ―¹–Β–Κ―É–Ϋ–¥―É), –Α –¥–Μ–Η–Ϋ–Α ―¹–≤–Ψ–±–Ψ–¥–Ϋ–Ψ–≥–Ψ –Ω―Ä–Ψ–±–Β–≥–Α ―¹–Ψ―¹―²–Α–≤–Μ―è–Β―² ―¹–Ψ―²―΄–Β –¥–Ψ–Μ–Η –Φ–Η–Κ―Ä–Ψ–Ϋ–Α. –û–¥–Ϋ–Α–Κ–Ψ –≤ –Ϋ–Β–Κ–Ψ―²–Ψ―Ä―΄―Ö –Κ–Ψ―¹–Φ–Η―΅–Β―¹–Κ–Η―Ö ―É―¹–Μ–Ψ–≤–Η―è―Ö, –Ϋ–Α–Ω―Ä–Η–Φ–Β―Ä, –≤–Ψ –≤–Ϋ–Β―à–Ϋ–Η―Ö ―¹–Μ–Ψ―è―Ö –Α―²–Φ–Ψ―¹―³–Β―Ä –Ζ–≤–Β–Ζ–¥, –¥–Μ–Η–Ϋ–Α ―¹–≤–Ψ–±–Ψ–¥–Ϋ–Ψ–≥–Ψ –Ω―Ä–Ψ–±–Β–≥–Α –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ –±–Ψ–Μ―¨―à–Β –Η –Φ–Ψ–Ε–Β―² –¥–Ψ―¹―²–Η–≥–Α―²―¨ ―¹–Α–Ϋ―²–Η–Φ–Β―²―Ä–Ψ–≤, –Α –≤ ―²―É–Φ–Α–Ϋ–Ϋ–Ψ―¹―²―è―Ö –≥–Α–Ζ –Ϋ–Α―¹―²–Ψ–Μ―¨–Κ–Ψ ―Ä–Α–Ζ―Ä–Β–Ε–Β–Ϋ, ―΅―²–Ψ ―¹―²–Ψ–Μ–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η―è ―΅–Α―¹―²–Η―Ü –Φ–Ψ–≥―É―² –Ω―Ä–Ψ–Η―¹―Ö–Ψ–¥–Η―²―¨ ―Ä–Α–Ζ –≤ –¥–Β―¹―è―²–Κ–Η –Η ―¹–Ψ―²–Ϋ–Η –Μ–Β―². –½–Α ―ç―²–Ψ –≤―Ä–Β–Φ―è ―΅–Α―¹―²–Η―Ü―΄ ―É―¹–Ω–Β–≤–Α―é―² ―¹–Ψ–≤–Β―Ä―à–Η―²―¨ –Ψ–≥―Ä–Ψ–Φ–Ϋ―΄–Β –Ω―Ä–Ψ–±–Β–≥–Η –≤ –¥–Β―¹―è―²–Κ–Η –Α―¹―²―Ä–Ψ–Ϋ–Ψ–Φ–Η―΅–Β―¹–Κ–Η―Ö –Β–¥–Η–Ϋ–Η―Ü. |